Definición:
Un ácido es aquella sustancia que al disolverse incrementa su concentración de iones de hidrógeno. Estos, combinados con bases, pueden llegar a formar sales.
Los ácidos se pueden presentar de forma líquida, sólida o gaseosa (dependiendo de su temperatura). Los ácidos también se caracterizan por ser corrosivos.
Binarios:
Son compuestos en los que en la formación de una molécula de los mismos intervienen un elemento del grupo 16 o 17 (además de ser un no metal), y el hidrógeno.
Para formularlo se pone el signo del hidrógeno primero y a su derecho el otro elemento con las características ya pedidas.
Ejemplos:
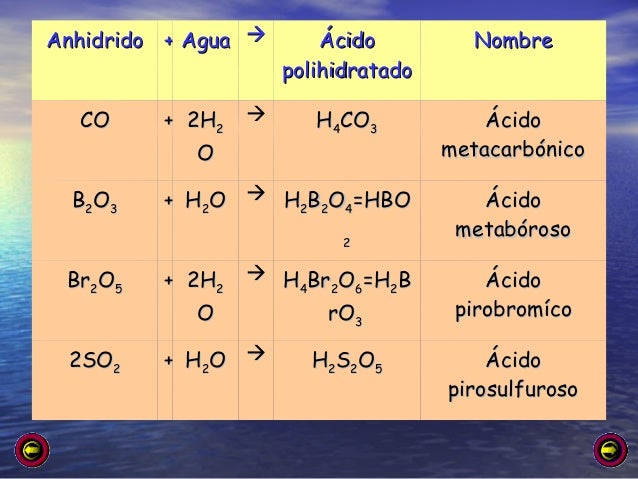 Por intuición podemos definir que los ácidos polihidratados son aquellos que poseen varias moléculas de agua. Un ácido polihidratado es aquel donde hay un óxido ácido más una variable cantidad de H2O.
Por intuición podemos definir que los ácidos polihidratados son aquellos que poseen varias moléculas de agua. Un ácido polihidratado es aquel donde hay un óxido ácido más una variable cantidad de H2O.
Ejemplos:
Estos son: ácido peroxonítrico, ácido peroxocarbónico, ácido peroxodisulfúrico y ácido peroxosulfúrico.
Un ácido es aquella sustancia que al disolverse incrementa su concentración de iones de hidrógeno. Estos, combinados con bases, pueden llegar a formar sales.
Los ácidos se pueden presentar de forma líquida, sólida o gaseosa (dependiendo de su temperatura). Los ácidos también se caracterizan por ser corrosivos.
Binarios:
Son compuestos en los que en la formación de una molécula de los mismos intervienen un elemento del grupo 16 o 17 (además de ser un no metal), y el hidrógeno.
Para formularlo se pone el signo del hidrógeno primero y a su derecho el otro elemento con las características ya pedidas.
Ejemplos:
- Ácido fluorhídrico - Fórmula: HF
- Ácido clorhídrico - Fórmula: HCI
- Ácido bromhídrico - Fórmula: HBr
Ternarios:
Los ácidos ternarios o también llamados ácidos oxoácidos son compuestos ternarios formados por un no metal, oxígeno e hidrógeno.
Eston son obtenidos a partir del óxido ácido correspondiente, más una molécula de agua, en otras palabras H2O.
Ejemplos:
- Ácido oxofluórico - Fórmula: HFO
- Ácido dioxosulfúrico - Fórmula: H2SO2
- Ácido cloroso - Fórmula: HClO2
Polihidratados:
 Por intuición podemos definir que los ácidos polihidratados son aquellos que poseen varias moléculas de agua. Un ácido polihidratado es aquel donde hay un óxido ácido más una variable cantidad de H2O.
Por intuición podemos definir que los ácidos polihidratados son aquellos que poseen varias moléculas de agua. Un ácido polihidratado es aquel donde hay un óxido ácido más una variable cantidad de H2O.
La cantidad de moléculas de agua depende de la ubicación del óxido no metálico, si es que este está en los grupos 13, 15 o 16, la cantidad de H2O es 3; si es que está en el grupo 14 14 va a ser 2; y si está en el grupo 17 va a ser 5.
Ejemplos:
- Ácido ortoperyódico - Fórmula: H10I2O12
- Ácido ortotelúrico - Fórmula: H6TeO6
Poliácidos:
Son similares a los polihidratados, solo que se diferencian en que estos en vez de tener dos o más moléculas de agua tienen más de una molécula de ácidos, esto más la pérdida de una molécula de agua por cada unión que se realice.
Ejemplos:
- Ácido disulfúrico - Fórmula: H2S2O7
- Ácido tricarbónico - Fórmula: H2C3O7
- Ácido dicarbónico - Fórmula: H2C2O5
Tioácidos:
Se obtienen al sustituir en un oxoácido uno o varios átomos de oxígeno por átomos de azufre divalentes.Ejemplos:
- Ácido Tetratiofofórico - Fórmula: H3PO4 (se sustituye los 4 átomos de oxigeno del ácido fosfórico por 4 de azufre)
- Ácido Tiosulfúrico - Fórmula: H2S2O3 (se sustituye un átomo de oxigeno del ácido fosfórico)
Halogenados:
Son sustancias químicas orgánicas que contienen uno o varios átomos de un elemento halógeno.
Pueden ser sustancias simples y volátiles (como el triclorometano) o moléculas.
 Se obtiene sustituyendo un grupo de oxo O2-
Se obtiene sustituyendo un grupo de oxo O2-
, del ácido correspondiente, por el grupo peroxo O22-Peoxiácidos:
Estos son: ácido peroxonítrico, ácido peroxocarbónico, ácido peroxodisulfúrico y ácido peroxosulfúrico.
Comentarios
Publicar un comentario